OFFERTA SPECIALE
OFFERTA SPECIALE
Tutto il sito - Mese
6,99€ 1 € al mese x 12 mesi
oppure
1€ al mese per 6 mesi
Tutto il sito - Anno
79,99€ 9,99 € per 1 anno
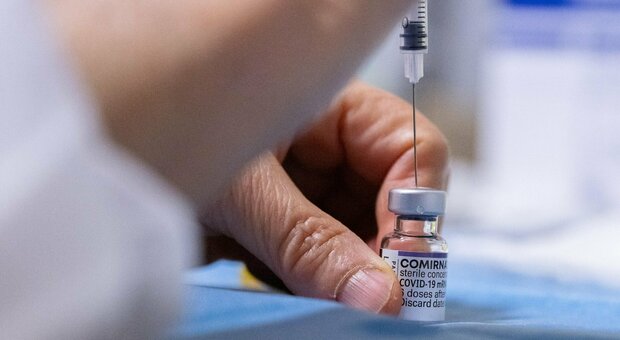
Ema ha iniziato a valutare la richiesta di autorizzazione del vaccino anti-covid contro le varianti Omicron 4 e Omicron 5 sviluppato da Pfizer e Biontech. Lo ha comunicato l'agenzia europea del farmaco su twitter.
Vaccino contro le varianti, atteso l'ok a settembre
Pfizer e BioNTech nei mesi scorsi hanno presentato negli Usa, alla Fda, e successivamente all'Ema in Europa la richiesta di autorizzazione all'uso di emergenza del vaccino adattato.
La domanda presentata negli Usa richiede il via libera al vaccino aggiornato per l'utilizzo di una dose di richiamo di 30 microgrammi in persone di età dai 12 anni in su. Dopo l'ok le dosi aggiornate potranno entrare in commercio ed essere inserite nella campagna vaccinale di richiamo per la quarta dose.
Da quarta dose ad aumento casi: OMS avverte e detta la strategia
Le tappe della campagna vaccinale
L'obiettivo di Ema dovrebbe essere quello di approvare il vaccino "adattato" già nel mese di settembre, in modo da essere nei tempi per le campagne vaccinali d'autunno-inverno. Va capita, però, la fattibilità di questa deadline.
Anche negli Usa l'intenzione della Fda è quella di approvarle quanto prima le richieste di Pfizer e Moderna, senza aspettare dati clinici specifici. Un'opzione che «potrebbe essere presa in considerazione anche in Ue», spiegano fonti riportate da Adnkronos «ma solo dopo attenta analisi di tutti i dati clinici generati con diversi vaccini che includono diverse varianti come Beta e Delta».
Al via i test clinici
Moderna ha affermato di aver iniziato la sperimentazione umana sul nuovo vaccino Omicron 4-5 questo mese, mentre Pfizer ha annunciato che uno studio clinico, che esaminerà la sicurezza, la tollerabilità e l'immunogenicità del vaccino bivalente Omicron BA.4/BA.5 negli over 12, dovrebbe partire sempre questo mese. Secondo i media Usa, i dati iniziali di tali studi sono attesi entro la fine dell'anno.
Leggi l'articolo completo su
Il Messaggero